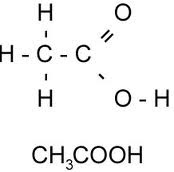
Pengertian Asam Lemak
Asam lemak adalah suatu senyawa golongan asam karboksilat
yang mempunyai rantai alifatik panjang, baik jenuh maupun tak jenuh.
Asam lemak alami mempunyai rantai dengan jumlah atom karbon genap dari 4
hingga 28. Asam lemak merupakan turunan dari trigliserida atau
fosfolipid. Asam lemak bebas adalah asam lemak yang tidak terikat pada
molekul lain. Asam lemak merupakan sumber bahan bakar makhluk hidup yang
sangat penting, karena ketika termetabolisme, asam lemak menghasilkan
ATP dengan jumlah yang besar. Beberapa tipe sel depat menggunakan baik karbohidrat ataupun asam lemak sebagai bahan bakar.
cis
Konfigurasi cis berarti atom hidrogen berada dalam sisi yang sama pada atom karbon ikatan rangkap. Kekakuan ikatan rangkap membekukan konformasinya. Konfigurasi cis menyebabkan bengkoknya rantai dan mencegah bebasnya asam lemak untuk berkonformasi. Ikatan rangkap konfigurasi cis mempunyai fleksibilitas yang rendah. Asam lemak tak jenuh yang mempunyai ikatan konfigurasi cis disebut dengan lemak cis.
trans
Konfigurasi trans berarti atom hidrogen berada dalam sisi yang berseberangan pada atom karbon berikatan rangkap. Asam lemak tak jenuh dengan konfigurasi trans tidak terlalu bengkok, dan bentuknya hampir sama dengan asam lemak jenuh. Asam lemak dengan konfigurasi trans disebut lemak trans.
Pada asam lemak tak jenuh alami, masing-masing ikatan rangkap mempunyai tiga n atom karbon setelahnya, untuk beberapa n, semuanya berikatan rangkap cis. Sebagian besar asam lemak yang mempunyai konfigurasi trans (lemak trans) tidak terdapat di alam.
Contoh lemak tak jenuh. Di bawah ini adalah tabel lengkap dari contoh-contoh asam lemak tak jenuh.
Contoh asam lemak jenuh disajikan pada tabel berikut:
Biosintesis asam lemak melibatkan kondensasi asetil-CoA. Karena koenzim membawa dua gugus beratom karbon dua, hampir semua asam lemak alami mempunyai jumlah atom karbon genap.
Jenis-jenis Asam Lemak
Asam lemak mempunyai ikatan rangkap karbon-karbon yang dikenal dengan istilah tidak jenuh. Asam lemak tanpa ikatan rangkap dikenal sebagai asam lemak jenuh. Asam lemak tak jenuh dan jenuh tentu mempunyai perbedaan panjang ikatan.Asam lemak tak jenuh
Asam lemak tak jenuh mempunyai satu atau lebih ikatan rangkap antara atom karbon. Dua atom karbon yang terikat pada atom-atom karbon yang berikatan rangkap satu sama lain mempunyai konfigurasi cis-trans.cis
Konfigurasi cis berarti atom hidrogen berada dalam sisi yang sama pada atom karbon ikatan rangkap. Kekakuan ikatan rangkap membekukan konformasinya. Konfigurasi cis menyebabkan bengkoknya rantai dan mencegah bebasnya asam lemak untuk berkonformasi. Ikatan rangkap konfigurasi cis mempunyai fleksibilitas yang rendah. Asam lemak tak jenuh yang mempunyai ikatan konfigurasi cis disebut dengan lemak cis.
trans
Konfigurasi trans berarti atom hidrogen berada dalam sisi yang berseberangan pada atom karbon berikatan rangkap. Asam lemak tak jenuh dengan konfigurasi trans tidak terlalu bengkok, dan bentuknya hampir sama dengan asam lemak jenuh. Asam lemak dengan konfigurasi trans disebut lemak trans.
Pada asam lemak tak jenuh alami, masing-masing ikatan rangkap mempunyai tiga n atom karbon setelahnya, untuk beberapa n, semuanya berikatan rangkap cis. Sebagian besar asam lemak yang mempunyai konfigurasi trans (lemak trans) tidak terdapat di alam.
Contoh lemak tak jenuh. Di bawah ini adalah tabel lengkap dari contoh-contoh asam lemak tak jenuh.
| Nama | Rumus Struktur |
|---|---|
| Asam miristoleat | CH3(CH2)3CH=CH(CH2)7COOH |
| Asam palmitoleat | CH3(CH2)5CH=CH(CH2)7COOH |
| Asam sapienat | CH3(CH2)8CH=CH(CH2)4COOH |
| Asam oleat | CH3(CH2)7CH=CH(CH2)7COOH |
| Asam elaidat | CH3(CH2)7CH=CH(CH2)7COOH |
| Asam vaksenat | CH3(CH2)5CH=CH(CH2)9COOH |
| Asam linoleat | CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH |
| Asam linoelaidat | CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH |
| Asam α linoleat | CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH |
| Asam arakhidonat | CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH |
| Asam eikosapentaenoat | CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH |
| Asam erukat | CH3(CH2)7CH=CH(CH2)11COOH |
Asam lemak jenuh
Asam lemak jenuh merupakan asam karboksilat rantai panjang dengan panjang rantai 12 hingga 24 dan tidak berikatan rangkap. Karena asam lemak jenuh hanya mempunyai iakatan tunggal, masing-masing atom karbon dalam rantai mengikat dua atom hidrogen kecuali karbon omega yang mempunyai tiga atom hidrogen pada ujungnya.Contoh asam lemak jenuh disajikan pada tabel berikut:
| Nama | Rumus Struktur |
|---|---|
| Asam kaprilat | CH3(CH2)6COOH |
| Asam kaprat | CH3(CH2)8COOH |
| Asam laurat | CH3(CH2)10COOH |
| Asam miristat | CH3(CH2)12COOH |
| Asam palmitat | CH3(CH2)14COOH |
| Asam stearat | CH3(CH2)16COOH |
| Asam arakhidat | CH3(CH2)18COOH |
| Asam bahenat | CH3(CH2)20COOH |
| Asam lignoserat | CH3(CH2)22COOH |
| Asam serotat | CH3(CH2)24COOH |
Pembuatan Asam Lemak
Dalam industri asam lemak dibuat dari trigliserida melalui reaksi hidrolisis, dengan pelepasan gliserol. Beberapa asam lemak dibuat dengan cara hidrokarboksilasi alkena.Biosintesis asam lemak melibatkan kondensasi asetil-CoA. Karena koenzim membawa dua gugus beratom karbon dua, hampir semua asam lemak alami mempunyai jumlah atom karbon genap.